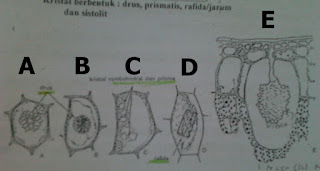
Untuk kesempatan pertama, saya akan memaparkan secara sederhana mengenai cara menganalisis unsur terlebih dahulu, baru kemudian saya akan memaparkan cara menganalisis gugusan.
Seperti yang kita ketahui, di alam ini terdapat dua unsur, yaitu unsur nonlogam dan unsur logam. Contoh dari unsur-unsur yang termasuk ke dalam unsur nonlogam antara lain C, H, O, N, S, P, dan unsur-unsur yang termasuk golongan halogen. Sementara contoh dari unsur-unsur logam antara lain Sn, Cr, Fe, Mg, As, Pb, Li, K, Ba, Bi, Cu, Cd, Ca, Mn, Na, Sb, Sr, Zn, dan Al. Beberapa dari contoh tersebut akan saya jelaskan di bawah ini.
Pertama, saya akan menjelaskan cara mengidentifikasi atau menganalisis suatu senyawa yang mengandung unsur
C. Penyelidikannya bisa dilakukan dengan 3 caraantara lain pengarangan/vercaling/pirolisis, percobaan penfield, dan pemijaran dengan CuO.
Dengan pengarangan/vercaling/pirolisis,
prinsipnya adalah terbentuknya perubahan warna mejadi coklat atau hitam pada senyawa
yang diamati. Cara kerjanya begini, zat yang akan diamati diletakkan di cawan
porselen, panaskan tetapi apinya jangan langsung mengenai bawah zat tersebut
agar perubahan warna mudah diamati (saya sendiri agak bingung dengan pernyataan
tersebut, namun begitulah yang tertulis di buku panduan saya). Kemudian amati
gejala pengarangannya, akan terjadi perubahan warna menjadi coklat atau
hitam.
Ketika dipanaskan kembali, warna hitam tersebut
dapat menghilang. Penghilangan warna tersebut dapat dipercepat dengan pemberian
HNO3.
Kemudian dengan cara percobaan penfield,
prinsipnya adalah terbentuknya warna putih. Pereaksi yang digunakan pada
percobaan ini antara lain PbCrO4 dan Ba(OH)2. Caranya, sebelum memberi
perlakuan pada zatnya, perlu untuk mempersiapkan pereaksinya. PbCrO4 dilumerkan
terlebih dahulu kemudian dihaluskan, setelah itu dimasukkan ke dalam tabung
sempit sebanyak 0,5 gram dan tambahkan pula zat yang akan diamati sebanyak 25
mg. Tabung sempit tersebut kemudian diletakkan mendatar, panaskan campuran
zat tersebut dengan pereaksi berikutnya, yaitu Ba(OH)2. Dengan inilah apabila
terdapat unsur C akan terbentuk warna putih.
Warna putih yang dihasilkan merupakan senyawa
BaCO3. Senyawa ini dihasilkan berturut-turut dimulai ketika PbCrO4 direaksikan
dengan zat yang mengandung unsur C yang kemudian akan membentuk senyawa PbCO3.
Dengan pemanasan lebih lanjut, PbCO3 tersebut akan terurai menjadi PbO dan CO2.
Ketika direaksikan selanjutnya dengan Ba(OH)2 inilah terbentuk senyawa BaCO3
yang memberikan warna putih.
Cara yang telah saya sebutkan dalam percobaan
penfield ini sebelumnya berlaku untuk zat-zat yang tidak mudah menguap. Untuk
zat yang mudah menguap mendapatkan perlakuan yang berbeda.
Kalau saya tidak salah memahami, perbedaannya
adalah pereaksi PbCrO4nya dipijarkan dalam tabung sempit (jadi tidak dilumerkan
kemudian dihaluskan seperti yang sebelumnya). Kemudian zat yang diamati
ditambahkan ke dalam pijaran, karena mudah menguap maka perlu segera ditutup
menggunakan penutup gabus tetapi ditutup dengan longgar. Setelah itu letakkan
tabung secara mendatar dan alirkan dengan air barit (Ba(OH)2), amati perubahan
warnanya.
Sementara pemijaran dengan CuO mekanismenya begini, CuO yang halus dipijar, dimasukkan ke dalam tabung, didinginkan. Lalu CuO harus kering kemudian ditambah dengan zat yang akan diamati, dipijar lagi. Dengan adanya campuran tersebut akan dihasilkan CO2 yang dapat diidentifikasi dengan dialirkannya CuO tersebut ke dalam air barit (Ba(OH)2) yang ditandai dengan adanya kekeruhan.
Kedua, saya akan menjelaskan cara untuk mengidentifikasi dan menganalisis unsur N. Unsur N ini dapat dianalisis dengan 3 cara, yaitu dengan percobaan kjeldahl, Faraday, dan Lassaigne.
Dengan percobaan Kjedahl, dibebaskannya NH3 yang dapat ditunjukkan keberadaannya dengan pereaksi nessler. Percobaan ini membutuhkan 3 pereaksi, yaitu H2SO4, H2O, dan NaOH.
Caranya adalah memasukkan zat yang akan diamati ke dalam tabung reaksi, lalu tambahkan dengan H2SO4, panaskan. Setelah itu didinginkan, lalu encerkan dengan H2O. Di akhir, tambahkan dengan NaOH sampai reaksi basa (alkalis). Saat itulah kemudian periksa dengan pereaksi nessler, apabila menunjukkan hasil positif maka zat tersebut mengandung unsur N.
Dengan percobaan Faraday, prinsipnya adalah terbentuk NH3 yang dapat ditunjukkan dengan birunya kertas lakmus. Pereaksi yang dibutuhkan antara lain CaO dan asbes.
Caranya adalah dengan memasukkan zat yang akan diamati ke dalam tabung reaksi, tambahkan dengan CaO, panaskan, mula-mula dengan suhu yang rendah, perlahan-lahan dinaikkan hingga memijar. Setelah itu didinginkan. Di bagian atas tabung diletakkan asbes dan di atas asbes tersebut diletakkan kertas lakmus. Apabila lakmus menjadi biru maka zat tersebut mengandung unsur N.
Kemudian dengan percobaan Lassaigne, prinsipnya adalah membuat filtrat lassaigne terlebih dahulu lalu diperlakukan dengan percobaan lain yang sesuai. Selain itu, pada prinsipnya, adanya unsur N tersebut ditunjukkan dengan adanya perubahan warna menjadi warna biru berlin.
Cara membuat filtrat lassaigne-nya terlebih dahulu adalah sebagai berikut:
Prinsipnya adalah terbentuknya senyawa NaCN pada zat yang mengandung unsur N dengan pereaksinya adalah Na. Caranya adalah dengan memasukkan Na ke dalam tabung reaksi dan menambahkannya dengan zat yang akan diamati, panaskan hingga memijar. Miringkan tabung sedikit agar lebih tercampur. Kemudian didinginkan, setelah itu ditambahkan air, aduk, didihkan sebentar, lalu disaring dengan kertas saring. Filtrat yang dihasilkan harus jernih. Apabila tidak jernih maka dekstruksi tidak sempurna dan percobaan harus diulang kembali.
Filtrat lassaigne yang telah dibuat kemudian digunakan untuk mengidentifikasi adanya unsur N. Prinsipnya adalah adanya perubahan warna menjadi biru berlin seperti yang sudah saya sebutkan sebelumnya. Pereaksi yang digunakan antara lain FeSO4 dan H2SO4.
Caranya adalah dengan memasukkan kristal FeSO4 ke dalam tabung reaksi, kemudian ditambahkan dengan filtrat lassaigne yang telah dibuat, panaskan perlahan-lahan sambil dikocok dan tambahkan H2SO4 secukupnya hingga terbentuk warna biru berlin.
Ketiga, saya akan menjelaskan mengenai cara menganalisis atau mengidentifikasi adanya unsur P. Penyelidikan unsur P ini dapat dilakukan dengan 4 cara, yaitu dengan cara percobaan kjeldahl, lassaigne, castellana, dan wurzschmit. Perlu diketahui bahwa bisa dibilang--berdasarkan pemahaman saya--bahwa percobaan wurzschmit ini merupakan percobaan spesifik untuk unsur P. Oleh karena itu saya akan menjelaskan dengan percobaan tersebut terlebih dahulu.
Dengan percobaan wurzschmit, prinsipnya adalah terbentuknya senyawa fosfat yang dapat ditunjukkan dengan penambahan molybdat. Pereaksi yang digunakan adalah HNO3 atau bisa juga menggunakan Natrium Peroksida.
Caranya adalah dengan memasukkan zat yang akan diamati ke dalam bom wurzschmit, tambahkan dengan HNO3 atau Natrium Peroksida, panaskan. Kemudian hasilnya dapat ditunjukkan dengan penambahan molybdat apabila terkandung unsur P. Penambahan molybdat tersebut apabila diamati menggunakan mikroskop akan terlihat adanya kristal spesifik.
Dengan percobaan kjeldahl, pereaksinya hampir sama dengan yang dilakukan untuk mengidentifikasi unsur N, yaitu H2SO4, H2O, serta amin molybdat dan HNO3 (berbeda dengan yang sebelumnya yang menggunakan NaOH bukan amin molybdat dan HNO3). Namun prinsipnya adalah terbentuk fosfat yang dapat ditunjukkan dengan amin molybdat dan HNO3 yang mana dapat terbentuk adanya kristal spesifik yang dapat diamati melalui mikroskop.
Caranya adalah dengan memanaskan zat yang akan diamati dengan H2SO4 di dalam tabung reaksi. Dinginkan, kemudian encerkan dengan H2O. Lalu tambahkan HNO3 dan amin molybdat. Gunakan mikroskop untuk melihat kristal spesifik. Selain itu setelah ditambahkan kedua pereaksi terakhir bisa ditambahkan NH4NO3 agar dapat memberikan endapan berwarna kuning.
Dengan percobaan lassaigne, prinsipnya adalah terbentuknya senyawa Na3P atau PH3 pada filtrat lassaigne. Cara pembuatannya sama seperti yang sebelumnya, namun setelah filtrat lassaigne jadi, kemudian diperlakukan dengan perlakuan yang sesuai, tidak sama dengan yang sebelumnya.
Cara dan prinsip yang lebih spesifiknya saya tidak bisa jelaskan karena tidak terdapat pada buku panduan yang saya miliki.
Kemudian dengan percobaan castellana, prinsipnya sama dengan percobaan lassaigne, hanya saja percobaan castellana ini bisa dikatakan merupakan percobaan perbaikan dari lassaigne. Sebagaimana kita tahu bahwa pereaksi yang digunakan pada percobaan lassaigne adalah Na, dan Na itu sendiri mudah meledak dengan air, maka di percobaan castellana ini dicoba untuk memperbaiki. Jadi, pereaksi yang digunakan tidak lagi Na, melainkan campuran Mg dan Na2CO3 dengan perbandingan 1:2. Selain lebih aman, percobaan ini lebih cepat.
Keempat, saya akan menjelaskan mengenai cara menganalisis atau mengidentifikasi unsur S. Unsur S ini dapat diselidiki dengan percobaan lassaigne dan castellana.
Dengan percobaan lassaigne, prinsipnya adalah terbentuknya senyawa Na2S atau S saja. Pereaksi yang digunakan sama dengan sebelumnya. Hanya saja kemudian ketika filtratnya lassaigne-nya jadi, kemudian diperlakukan dengan percobaan lain yang sesuai.
Percobaan lain yang bisa digunakan ada 3, dengan Pb-asetat, Na-Nitroprussida, dan KCNS.
Dengan Pb-asetat, prinsipnya adalah terbentuk endapan PbS berwarna hitam. Pereaksi yang digunakan tentunya Pb-asetat. Selain itu digunakan pula asam asetat. Jadi, caranya adalah dengan menambahkan asam asetat pada filtrat lassaigne-nya, kemudian ditambahkan larutan Pb-asetat, amati adanya perubahan warna menjadi hitam.
Dengan Na-Nitroprussida, prinsipnya terbentuk warna merah ungu. Pereaksi yang digunakan hanya Na-Nitroprussida. Caranya dengan menambahkan Na-Nitroprussida ke dalam filtrat lassaigne yang kemudian akan membentuk warna merah ungu apabila terdapat unsur S.
Dengan KCNS, prinsipnya akan terbentuk warna violet dengan pereaksinya KCNS sendiri. Caranya dengan menambahkan KCNS ke dalam filtrat lassaigne-nya. lalu amati perubahan warna menjadi violet yang menandakan adanya unsur S.
Kelima, saya akan menjelaskan mengenai cara untuk menyelidiki adanya unsur halogen pada suatu senyawa. Ada 3 cara antara lain dengan percobaan beilstein, faraday, dan lassaigne. Percobaan beilstein, bisa dikatakan merupakan percobaan spesifik untuk unsur halogen ini.
Percobaan beilstein, prinsipnya adalah berubah warnanya menjadi hijau. Pereaksi yang digunakan antara lain menggunakan kawat Cu, HNO3, dan oksida tembaga.
Caranya adalah dengan mencelupkan kawat Cu yang bersih ke dalam HNO3 kemudian pijarkan dengan dilakukan beberapa kali. Setelah itu, kawat Cu yang dipijar dicelupkan ke dalam oksida tembaga. Setelah itu, baru kemudian dicelupkan ke dalam zat yang akan diamati, panaskan. Akan terbentuk warna hijau jika positif.
Dengan percobaan faraday, prinsipnya adalah terbentuknya Ca-halogenida dengan pereaksi CaO. Caranya hampir sama dengan yang sebelumnya.
Dengan percobaan lassaigne, prinsipnya adalah terbentuknya endapan halogenida. Pereaksi yang digunakan antara lain HNO3/H2SO4 dan AgNO3.
Caranya adalah dengan mengasamkan filtrat lassaigne yang telah dibuat dengan HNO3/H2SO4, kemudian uapkan di penangas air dengan cawan penguap. Lalu hilangkan zat yang lain kembali dengan HNO3, tambahkan dengan AgNO3 hingga terbentuk endapan Ag-halogenida.
Untuk berikutnya, saya akan memaparkan mengenai cara menganalisis/mengidentifikasi/menyelidiki unsur yang logam. Pada unsur logam ini, perlu diperhatikan adanya 2 jenis, yaitu unsur logam yang dapat hilang dengan pemijaran dan unsur logam yang dapat meninggalkan sisa pijar. Dalam hal ini, hanya terdapat 2 unsur (yang saya ketahui) yang termasuk ke dalam logam yang dapat hilang dalam pemijaran yaitu As dan Hg.
Langsung saja, untuk yang keenam, saya akan menjelaskan cara menyelidiki unsur As. Prinsipnya adalah adanya perubahan warna pada kertas saring menjadi kuning, lalu hitam dan terciumnya bau bawang. Pereaksi yang digunakan Zn, H2SO4 encer, Pb-asetat, dan AgNO3.
Caranya adalah dengan memasukkan zat yang diperiksa ke dalam tabung reaksi, tambahkan Zn dan asam sulfat encer, panaskan. Leher tabung dibasahi dengan Pb-asetat, sementara mulut tabung ditutup kertas saring yang dibasahi dengan AgNO3 sehingga pada akhirnya dapat diamati perubahan warna pada kertas saring menjadi warna kuning, lalu hitam, dan tercium bau bawang.
Ketujuh, saya akan menjelaskan cara menganalisis unsur Hg. Prinsipnya akan terbentuk bercak abu-abu yang jika digosok akan berkilatan seperti perak. Pereaksi yang digunakan adalah tembaga putih.
Caranya adalah dengan dengan meneteskan zat yang mengandung Hg ke atas tembaga putih, maka akan terbentuk bercak abu-abu yang jika digosok akan berkilatan seperti perak.
Untuk berikutnya, saya akan menjelaskan unsur yang termasuk ke dalam unsur logam yang meninggalkan sisa pijar.
Kedelapan, saya akan menjelaskan cara menganalisis unsur Sn. Prinsipnya adalah terbentuknya endapan putih keabu-abuan. Pereaksi yang digunakan antara lain kalomel (Hg2Cl2) dan HCl. Caranya adalah dengan melarutkan zat yang akan diamati dengan HCl kemudian tambahkan dengan kalomel padat maka akan terbentuk endapan putih keabu-abuan. Hasil ini hanya dapat memberikan hasil positif untuk Sn2+ tidak untuk Sn 4+.
Kesembilan, unsur Cr. Prinsipnya adalah dengan terbentuknya massa hijau yang tak terleburkan. Pereaksinya antara lain Na2CO3 dan unsur C (sebagai katalis). Caranya adalah dengan zat yang akan diamati dipijarkan terlebih dahulu dengan menggunakan cawan krusibel, masukkan ke dalam tanur 800 derajat celcius sampai pijar, tambahkan Na2CO3 dan unsur C, nantinya akan terbentuk Cr2O3 yang merupakan massa berwarna hijau tak terleburkan.
Kesepuluh, unsur Mg. Prinsipnya adalah terbentuknya endapan berupa kristal putih. Pereaksi yang digunakan antara lain asam nitrat, amonium klorida, dan dinatrium hidrogen fosfat. Caranya adalah dengan mencampurkan zat yang akan diamati dengan asam nitrat encer, lalu tambahkan dengan amonium klorida dan berikan amonium berlebih, setelah itu reaksikan dengan dinatrium hidrogen fosfat maka akan terbentuk endapan berupa kristal putih.
Kesebelas, unsur Li. Unsur Li ini dapat dianalisis dengan 2 cara, yaitu reaksi nyala dan 1 reaksi lagi yang saya tidak tahu nama reaksinya apa.
Dengan reaksi nyala, prinsipnya terbentuk warna nyala merah karmin yang intensif. Pereaksi yang digunakan asam nitrat. Caranya adalah dengan melarutkan zat yang akan diamati dengan menggunakan asam nitrat lalu panaskan dengan api, maka akan memberikan nyala warna merah karmin intensif yang mewarnai bunsen.
Dengan cara melalui suatu reaksi, prinsipnya adalah terbentuknya endapan putih. Pereaksinya adalah asam klorida, natrium hidroksida, dan dinatrium hidrogen fosfat. Caranya adalah dengan melarutkan zat yang akan diamati dengan asam klorida, kemudian ditambahkan natrium hidroksida dan dinatrium hidrogen fosfat maka akan terbentuk endapan putih.
Kedua belas, unsur K dapat dianalisis dengan 4 macam reaksi. (1) Dengan reaksi nyala dapat memberikan warna nyala ungu menggunakan kaca kobalt. (2) Dengan ditambah asam asetat dan Na3Co(NO2)6 akan menghasilkan endapan kuning. (3) Dengan reaksi tripel nitrat dapat menghasilkan endapan berwarna biru kehitaman. (4) Dengan dipijarkan kemudian ditambah air, lalu asam pikrat, membentuk kristal endapan putih.
Ketiga belas, unsur Ba. Kita tahu bahwa unsur Ba memiliki sifat tidak larut dalam bentuk BaSO4. Oleh karena itu apabila suatu zat direaksikan dengan asam sulfat dan tidak dapat larut di mana-mana bisa kita katakan bahwa zat tersebut adalah Ba.
Selain itu, unsur Ba juga dapat diuji melalui reaksi nyala dan reaksi lainnya. Dengan reaksi nyala memberikan warna hijau biru. Dengan pereaksi asam asetat dan meditren akan dihasilkan warna jingga yang di bawah mikroskop memberikan bentuk seperti jarum-jarum. Caranya adalah dengan memijarkan zat terlebih dahulu baru kemudian ditambahkan asetat dan meditren.
Keempatbelas, unsur Bi. Ada sekitar 4 cara untuk mengidentifikasi Bi. (1) Dengan pemijaran apabila terbentuk warna kuning/jingga dan tidak mengalami perubahan warna maka zat tersebut mengandung unsur Bi, tetapi jika berwarna kuning/jingga tetapi mengalami perubahan warna menjadi putih maka zat tersebut mengandung unsur Zn. Reaksi warna saja tidak cukup. (2) Bi pada prinsipnya juga dapat membentuk amalgam dengan ditambahkan asam asetat atau asam klorida. (3) Selain itu, unsur Bi ini juga dapat berwarna merah apabila diasamkan dan ditambah denagn larutan iodium. (4) Dan terakhir bisa menjadi warna hitam apabila direaksikan dengan garam tioasetamid.
Kelima belas, unsur Cu. Ada dua cara, yang pertama membutuhkan pereaksi asam asetat, yang nantinya akan berwarna biru muda. Caranya adalah dengan memijarkan zat terlebih dahulu, kemudian sisa pijarnya dilarutkan dengan asam asetat, maka akan membentuk warna biru muda. Warnanya bisa menjadi biru tua apabila ditetesi dengan amonium hidroksida.
Keenam belas, unsur Cd. Dapat membentuk endapan kuning apabila direaksikan degan H2S.
Ketujuh belas, unsur Ca. Direaksikan dengan reaksi nyala memberikan warna merah batah. Tidak cukup hanya dengan reaksi nyala, untuk mengidentifikasinya perlu juga direaksikan dengan asam asetat dan meditren yang nantinya akan berwarna jingga. Selain itu, agar lebih pasti, direaksikan denagn asam oksalat, lihat di bawah mikroskop kana tampak kristal berwarna putih amplop.
Kedelapan belas, unsur Fe. Apabila diberi larutan yang mengandung Fe2+ maka akan menghasilkan endapan berwarna biru. Tetapi apabila direaksikan dengan amonium tiosianat akan menghasilkan senyawa Fe3+ yang berwarna merah tua.
Kesembilan belas, unsur Mn. (1) Dengan reaksi nyala, yaitu dengan zatnya dipijar, tambah asam asetat dan K-oksalat akan menghasilkan endapan roset (batang-batang). Kemudian untuk memastikan lagi, (2) zatnya dipijar, sisa pijar ditambah asam asetat, KOH, dan benzen asetat, maka akan berwarna biru. (3) Apabila zatnya dilarutkan kemudian ditambah natrium fosfat maka akan menghasilkan endapan merah jambu.
Kedua puluh, unsur Na. Reksi nyala natrium yang memberikan warna kuning sekiranya sudah banyak yang tahu. Tetapi bahwa Na dapat menghasilkan senya berbentuk jarum dengan asam pikrat dan menghasilkan endapan putih dengan K2H2Sb2O7 sekiranya belum banyak yang tahu. Selain itu, apabila Na dilarutkan kemudian ditambah dengan pereaksi Zn Uranium Asetat maka dapat membentuk kristal atau diamond yang terlihat di bawah mikroskop.
Kedua puluh satu, unsur Ni. Penyelidikannya hanya dilakukan dengan satu percobaan (berdasarkan buku panduan saya), jadi prinsipnya terbentuknya warna merah pada kertas saring. Pereaksinya basa dan dimetilglioksin. Caranya adalah dengan melarutkan zat tersebut, lalu buat dalam suasana basa, tambahkan dimetilglioksin. Letakkan kertas saring di atas botol NH3, maka akan terbentuk warna merah pada kertas saring.
Kedua puluh dua, unsur Sr. Dengan reaksi nyala akan berwarna merah jingga. Sementara ditambah dengan asam sulfat akan mengendap. Setelah itu dengan dilarutkan kemudian ditambah kalium kromat akan menghasilkan endapan kuning.
Untuk saat ini, cukup sekian yang dapat saya berikan. Mohon maaf apabila terdapat kesalahan. Kurang lebihnya mohon maaf. Semoga bermanfaat. Terima kasih sudah berkunjung :D